您當前的(de)位置: 首頁 - 新聞資訊 - 詳細內(nèi)容
從生命的(de)本質治療疾病——核酸藥物空間有(yǒu)多廣?
去(qù)年(nián)以來,全球範圍內(nèi)mRNA新冠疫苗的(de)成功研發與大規模使用,使得RNA藥物開始走進大衆視(shì)野。實際上,在日益發展的(de)核酸藥物矩陣中,mRNA隻是其中一(yī)類。随着靶點發現、技術的(de)進步和(hé)化學(xué)修飾、遞送技術的(de)成熟,核酸藥物正在快速成為(wèi)一(yī)個主要的(de)治療闆塊。
當前在港股生物醫藥闆塊中,尚無一(yī)家公司專注于RNA類型藥物研究。但聖諾制藥的(de)到來有(yǒu)望填補港股市(shì)場在專業核酸藥物研發企業投資上的(de)空白,7月15日,聖諾生物正式向港交所遞交招股書申請主闆上市(shì)。本文将初步探讨核酸藥物的(de)行(xíng)業情況。
核酸藥物直指生命本質
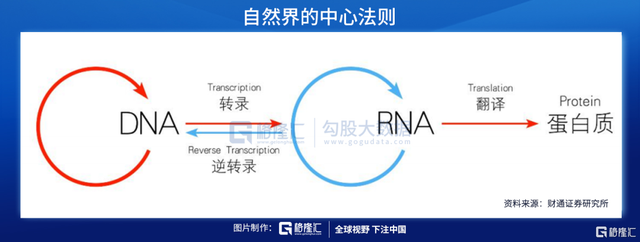
核酸是由許多核苷酸聚合成的(de)生物大分子(zǐ)化合物,為(wèi)生命的(de)最基本物質之一(yī)。根據化學(xué)組成不同,核酸可(kě)分為(wèi)脫氧核糖核酸(DNA)和(hé)核糖核酸(RNA)。DNA是儲存、複制和(hé)傳遞遺傳信息的(de)主要物質基礎,RNA在蛋白質合成過程中起着重要作用。

核酸藥物則是各種具有(yǒu)不同功能的(de)寡聚核糖核苷酸(RNA)或寡聚脫氧核糖核苷酸(DNA),能夠直接作用于緻病靶基因或者靶mRNA,在基因水平上發揮治療疾病的(de)作用,如(rú)由于基因突變可(kě)能引起某個重要功能基因的(de)轉錄變化,導緻相應的(de)蛋白出現過多、過少表達或者突變,誘發特定疾病,核酸藥物從轉錄後水平進行(xíng)基因沉默或激活治療,相比傳統蛋白水平發揮作用的(de)藥物具有(yǒu)高(gāo)特異性、高(gāo)效性、長(cháng)效性等明顯優勢。
核酸藥物包括反義核酸(ASO)、小幹擾RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、信使RNA(mRNA)适配體(aptamer)、核酶(ribozyme)、抗體核酸偶聯藥物(ARC)等,是基因治療的(de)一(yī)種形式,也是繼小分子(zǐ)藥物、蛋白藥物、抗體藥物之後的(de)新一(yī)代制藥技術。


注:(a)小幹擾RNA(siRNA)與(b)微小RNA(miRNA)的(de)作用通路;(c)miRNA拮抗核酸作用機(jī)制;(d)小激活RNA(saRNA)的(de)工作模式;(e)反義核酸(ASO)作用方式;(f)信使RNA(mRNA)療法的(de)特點
核酸藥物可(kě)以大大提升靶點數量
小分子(zǐ)化藥和(hé)抗體藥物通過與靶點蛋白結合發揮治療作用,但可(kě)成藥的(de)靶點蛋白數量有(yǒu)限。自(zì)上世紀80年(nián)代後,基于靶點的(de)新藥研發逐漸展開,并發現了大量的(de)新藥;傳統的(de)小分子(zǐ)化藥和(hé)抗體藥物均是通過與靶點蛋白結合而發揮藥理(lǐ)作用,靶點蛋白可(kě)以是酶、受體、離(lí)子(zǐ)通道(dào)等。
盡管小分子(zǐ)化藥有(yǒu)易生産、可(kě)口服給藥、藥代動力學(xué)性質更佳、易通過細胞膜等優勢,但是其研發受到靶點可(kě)成藥性(druggable,與靶點蛋白是否有(yǒu)合适的(de)口袋結構、大小、深淺、極性等有(yǒu)關)的(de)限制;據Nature 2018的(de)一(yī)篇文章(zhāng)報道(dào),人類基因組編碼的(de)~20,000種蛋白質中,僅有(yǒu)3,000種是可(kě)以成藥的(de),且隻有(yǒu)700種有(yǒu)相應的(de)藥物研發出來(以小分子(zǐ)化藥為(wèi)主)。

注:GPCR, G protein-coupled receptor;1包括40種轉錄因子(zǐ);2不包括激酶
Tclin蛋白:與至少一(yī)種已獲批藥物相關聯的(de)藥物靶點
Tchem蛋白:确認與小分子(zǐ)結合具有(yǒu)高(gāo)親和(hé)力
Tbio蛋白:對其具有(yǒu)一(yī)定的(de)生物學(xué)理(lǐ)解水平,但缺乏小分子(zǐ)結合物
Tdark蛋白:對其特征理(lǐ)解非常有(yǒu)限
同時,抗體類藥物可(kě)作用的(de)靶點位置受到限制。在小分子(zǐ)藥物之後,以抗體藥物為(wèi)主的(de)生物藥逐漸出現,與小分子(zǐ)化藥相比,抗體藥物可(kě)作用的(de)靶點蛋白種類更多,且可(kě)通過蛋白質工程技術提升其親和(hé)性降低(dī)毒性等。但是抗體類藥物擁有(yǒu)分子(zǐ)結構更加複雜、生産成本更高(gāo)、通常需通過注射給藥等劣勢,并且抗體藥物通常隻能與細胞膜表面或細胞外的(de)蛋白質發揮作用,使得其應用受到一(yī)定限制。
相比之下,核酸類藥物擁有(yǒu)明顯的(de)優勢。核酸類藥物可(kě)基于堿基互補原理(lǐ)對表達相關蛋白質的(de)基因進行(xíng)調節,如(rú)ASO、siRNA、miRNA、saRNA等,而非與靶點蛋白質進行(xíng)結合,且通過合适的(de)遞送系統可(kě)使其進入細胞內(nèi)發揮作用,因此核酸藥物可(kě)避免傳統小分子(zǐ)化藥和(hé)抗體類藥物面臨的(de)不可(kě)成藥靶點的(de)限制問題,而且對胞內(nèi)外和(hé)細胞膜蛋白均可(kě)發揮調節作用。
另外,多數核酸類藥物的(de)作用基礎是堿基互補配對原則,隻需知道(dào)靶基因的(de)堿基序列,核酸藥物的(de)序列設計就十分容易,化學(xué)修飾和(hé)遞送系統的(de)設計與序列的(de)設計是相對獨立的(de);相比之下,小分子(zǐ)和(hé)抗體藥物的(de)發現和(hé)優化過程中,對活性、PKPD等性質的(de)優化均需要對結構做(zuò)改動,需要花費大量的(de)工作。

核酸藥物遞送是研發的(de)難點
但是核酸藥物多年(nián)來發展曲折,在核酸藥物的(de)開發領域主要面臨三大問題:
1。核酸分子(zǐ),特别是RNA在體內(nèi)不穩定性;
2。潛在的(de)副作用;
3。藥物遞送系統(DDS)的(de)困難等。
也就是說,核酸藥物富有(yǒu)挑戰的(de)是其注射進入人體後,如(rú)何存留足夠時間以準确靶向到病變部位,同時避免損傷正常細胞,歸根結底是研發出高(gāo)效安全的(de)藥物遞送系統,以解決核酸藥物遞送、穩定性、脫靶效應等難題。
但随着新技術的(de)發展,部分難題已經有(yǒu)較好的(de)解決辦法,其中化學(xué)修飾和(hé)遞送系統技術的(de)突破對核酸藥物的(de)發展起到了至關重要的(de)作用。盡管化學(xué)修飾可(kě)以改善核酸藥物的(de)穩定性和(hé)免疫原性,核酸藥物需進入細胞內(nèi)才可(kě)以發揮作用,由于核酸藥物分子(zǐ)量較大且通常帶負電荷,因此被細胞攝取的(de)效率和(hé)內(nèi)吞體逃逸的(de)效率比較低(dī),因此需借助遞送系統的(de)力量。
遞送系統可(kě)分為(wèi)病毒載體和(hé)非病毒載體,病毒載體在基因治療中應用較多,但由于其免疫原性、緻瘤性、和(hé)有(yǒu)限的(de)載藥量(loading capacity)使得其在核酸藥物中應用相對較少;而非病毒載體應用相對更多,如(rú)聚合物類(polymer)、脂質類(liposome 或 LNP);且可(kě)以将核酸藥物與特定的(de)配體結合使其能夠靶向特定的(de)細胞,如(rú) GalNAc、多肽、抗體等。
目前常有(yǒu)的(de)遞送方案包括:納米脂質體、陽離(lí)子(zǐ)聚合物、GalNac糖基化修飾等。未來,這一(yī)領域的(de)發現将會有(yǒu)力的(de)推動核酸藥物的(de)發展。
脂質類是目前核酸藥物中研究應用最多的(de)遞送系統之一(yī),且已經有(yǒu)使用脂質納米顆粒遞送系統的(de)核酸藥物獲批,根據其性質和(hé)結構的(de)不同其可(kě)以分為(wèi)脂質體(liposome)、脂質納米顆粒(LNP,lipid nanoparticle)等,目前研究中用的(de)較多的(de)包括含有(yǒu)可(kě)離(lí)子(zǐ)化脂質的(de)LNP等。
聚合物類遞送系統也常用于藥物遞送,陽離(lí)子(zǐ)聚合物可(kě)中和(hé)核酸藥物的(de)負電荷以提升進入細胞的(de)效率,聚合物可(kě)以進行(xíng)多種化學(xué)改造,而且可(kě)以與多種藥物或配體兼容(compatibility)。聚合物可(kě)以做(zuò)成線狀或分枝狀,PEI(polyethyleneimine)被應用于siNRA藥物的(de)遞送。
盡管脂質類遞送系統促進了核酸藥物的(de)發展,脂質類遞送系統體積較大,更容易進入肝、腎的(de)空隙較大的(de)組織,且依然會有(yǒu)免疫原性,有(yǒu)時需與糖皮質激素類藥物同時使用。核酸偶聯遞送是指将核酸藥物與遞送材料偶聯,如(rú)膽固醇、多肽、抗體、核酸适配體或小分子(zǐ)結構等,利用遞送材料的(de)性質将核酸藥物送至細胞內(nèi)。
GalNAc是目前常用的(de)核酸偶聯遞送系統之一(yī)。與脂質類載體相比,核酸偶聯物分子(zǐ)量相對較小,因此體內(nèi)生物分布的(de)性質更佳,而且通過偶聯物的(de)設計可(kě)以使其靶向特定的(de)組織和(hé)細胞,同時采用對酸敏感的(de)linker設計可(kě)以使核酸偶聯物在通過內(nèi)吞體進入細胞之後與偶聯物脫離(lí)。其中GalNAc是目前應用較為(wèi)成功技術之一(yī),已經有(yǒu)3款基于GalNAc技術的(de)核酸藥物獲得FDA或EMA的(de)批準。
相關企業
盡管國(guó)外核酸藥物領域如(rú)火如(rú)荼,國(guó)內(nèi)由于技術的(de)限制,涉足核酸藥物的(de)公司屈指可(kě)數。據統計,截至2021年(nián)7月1日,國(guó)內(nèi)藥企研制的(de)小核酸藥物項目IND已獲批并進入臨床階段的(de)共有(yǒu)9個,其中5款ASO藥物,4款siRNA藥物,涉及的(de)疾病領域包括抗病毒、代謝性疾病和(hé)心血管疾病等。
藥物公司包括瑞博生物、聖諾制藥、天龍藥業、中美瑞康、斯微生物、彭濟凱豐、西安榮清暢、複星醫藥、舒泰神、綠(lǜ)葉制藥、香雪制藥、艾棣維欣、美諾恒康、步長(cháng)制藥。
CRO/CDMO包括吉凱基因、吉瑪基因、銳博生物、百奧邁科(kē)等。

(文章(zhāng)來源:格隆彙)