您當前的(de)位置: 首頁 - 新聞資訊 - 詳細內(nèi)容
目前SARS-CoV-2臨床試驗用脂質納米顆粒的(de)開發
mRNA最早的(de)轉染試劑是季铵化陽離(lí)子(zǐ)DOTAP結合可(kě)電離(lí)和(hé)融合的(de)DOPE,采用DNA轉染[85],用于在衆多細胞類型中轉染mRNA[86]。盡管在體外有(yǒu)效,但永久性陽離(lí)子(zǐ)季铵基團使這些大尺寸的(de)脂複合物從循環和(hé)其通常靶器官肺中迅速清除,并表現出毒性。今天LNP的(de)先驅是穩定的(de)質粒-脂質顆粒(SPLP),它是由融合基因電離(lí)的(de)DOPE與季铵化的(de)陽離(lí)子(zǐ)脂質DODAC結合形成的(de),DODAC靜電結合并包裹質粒DNA,然後用親水性PEG包被,使其在水介質中穩定,并在體內(nèi)給藥時限制蛋白質和(hé)細胞相互作用[87]。DOPE在細胞攝取後可(kě)在內(nèi)涵體中質子(zǐ)化,由于呈錐形,因此可(kě)與內(nèi)涵體磷脂形成內(nèi)體溶解離(lí)子(zǐ)對,以促進內(nèi)涵體釋放,這是成功遞送的(de)關鍵事件[17]。然後進一(yī)步将SPLP開發為(wèi)含有(yǒu)siRNA的(de)穩定核酸脂質顆粒(SNALP),包括四種脂質:離(lí)子(zǐ)化而不是季铵化陽離(lí)子(zǐ)脂質、飽和(hé)雙層形成季铵化兩性離(lí)子(zǐ)脂質、DSPC、膽固醇和(hé)PEG脂質[88]。除了與核酸靜電結合外,SNALPs中的(de)可(kě)電離(lí)脂質發揮了融合脂質的(de)作用,并在內(nèi)涵體中質子(zǐ)化,與內(nèi)涵體磷脂形成膜不穩定離(lí)子(zǐ)對。目前已知DSPC有(yǒu)助于在PEG表面下形成穩定的(de)雙層[89]。膽固醇發揮多種作用,包括填補顆粒間隙、限制LNP–蛋白質相互作用和(hé)可(kě)能促進膜融合[90]。可(kě)電離(lí)脂質在生理(lǐ)pH下呈中性,從而消除循環中的(de)任何陽離(lí)子(zǐ)電荷,但在pH~6.5的(de)內(nèi)體中質子(zǐ)化,促進內(nèi)體釋放,發揮核心作用。
2018年(nián)臨床批準的(de)首個siRNA産品的(de)開發主要集中在優化可(kě)電離(lí)脂質,其次是PEG脂質和(hé)LNP中使用的(de)四種脂質的(de)比例,以及LNP組裝和(hé)生産程序。根據分子(zǐ)形狀假設[12,91],發現C18尾中不飽和(hé)鍵的(de)最佳數量是通過醚連接到二甲胺頭基的(de)二亞油酸尾[88]。然而,在亞油酸尾部引入單個連接體,其具有(yǒu)從二甲胺頭基到連接體的(de)優化碳數,導緻LNP中可(kě)電離(lí)脂質DLin-MC3-DMA的(de)pKa接近6.4[92,93]。優化的(de)最後一(yī)步是将MC3/DSPC/膽固醇/PEG–脂質的(de)這些脂質摩爾比調節至50/10/38.5/1.5。總體從DLin-DMA到DLin-MC3-DMA的(de)這一(yī)優化過程需要在數千種制劑中篩選超過300種可(kě)電離(lí)的(de)脂質,并導緻效價增加200倍和(hé)有(yǒu)效劑量相應減少,以實現對靶基因> 80%的(de)持久抑制和(hé)允許治療窗,2018年(nián)Onpattro™獲得臨床批準[94,95]。這種為(wèi)siRNA開發的(de)MC3配方是随後開發LNPs的(de)基礎,如(rú)下所述(圖1),在被批準用于SARS-CoV-2 mRNA疫苗的(de)遞送後,LNPs現在正被緊急使用。

圖1 mRNA脂質納米顆粒結構。最近使用冷凍電子(zǐ)顯微鏡[96]、小角中子(zǐ)散射和(hé)小角X射線散射[89]進行(xíng)的(de)研究表明,mRNA脂質納米顆粒包括低(dī)拷貝數的(de)mRNA(1-10),并且mRNA與占據LNP中心核心的(de)可(kě)電離(lí)脂質結合。聚乙二醇(PEG)脂質形成脂質納米顆粒(LNP)的(de)表面,同時形成雙層的(de)DSPC。帶電荷和(hé)不帶電荷的(de)膽固醇和(hé)可(kě)電離(lí)脂質可(kě)分布在整個LNP中。其他輸送系統的(de)結構示意圖在最近的(de)綜述中提供[14]。
Moderna使用上述Onpattro制劑中的(de)MC3進行(xíng)了幾項臨床前[97,98,99]和(hé)臨床研究[97,100],以遞送核苷修飾的(de)mRNA編碼免疫原。在這些比較新的(de)一(yī)類可(kě)電離(lí)脂質與MC3的(de)研究中,MC3後來被确定為(wèi)可(kě)電離(lí)脂質[42,101]。這個新類别包括Lipid H[42],它是Moderna的(de)SARS-CoV-2産品mRNA-1273中的(de)可(kě)電離(lí)脂質SM-102[41](表2)。
使用針對寨卡病毒的(de)核苷修飾的(de)mRNA編碼免疫原,MC3 LNP能夠保護缺乏I型和(hé)II型幹擾素(IFN)信号的(de)免疫功能低(dī)下小鼠免受10µg劑量1次或2µg劑量初免-加強免疫設計的(de)緻死攻擊[99]。在預先給予抗ifnar1阻斷抗體以建立緻死模型的(de)免疫功能正常小鼠中也獲得了相似的(de)結果。在一(yī)系列遞送核苷修飾的(de)mRNA編碼血凝素(HA)免疫原的(de)流感研究中,皮內(nèi)遞送的(de)MC3 LNP能夠完全保護小鼠免受低(dī)至0.4µg單次給藥的(de)緻死性攻擊,盡管即使單次給予高(gāo)達10µg劑量,攻毒後也會出現體重減輕[97]。雪貂單次給予50µg或100µg劑量産生了較高(gāo)的(de)HAI(血凝抑制試驗)滴度,非人靈長(cháng)類動物單次給予200或400µg劑量也産生了較高(gāo)的(de)HAI滴度。在接受100µg劑量的(de)少數(23)人類受試者中,在研究開始時,所有(yǒu)受試者的(de)HAI滴度均 > 40(who保護相關性),比基線高(gāo)4倍以上。在一(yī)項更大規模的(de)1期試驗中,使用相同的(de)MC3 LNPs遞送兩種不同的(de)核苷修飾的(de)mRNA編碼的(de)HA免疫原,肌肉注射100µg的(de)H10N8免疫原導緻23名受試者中100%的(de)HAI滴度 > 40[100]。盡管未發生危及生命的(de)不良事件,但這23例受試者中有(yǒu)3例發生了重度3級不良事件。3例受試者中的(de)2例發生3級不良事件(符合研究暫停規則)後,停止計劃的(de)400µg給藥。在較低(dī)劑量下,不良事件的(de)頻率和(hé)嚴重程度降低(dī),但幾乎每例受試者均發生至少1起不良事件。這些研究很有(yǒu)前景,但也強調了在不會引起問題數量的(de)不良事件的(de)劑量下獲得保護性免疫的(de)治療窗相對較窄。這讓人想起MC3前體DLin-DMA的(de)治療窗窄,需要提高(gāo)效力才能降低(dī)劑量,仍然實現有(yǒu)效的(de)基因敲低(dī)。
表2脂質納米顆粒中使用的(de)可(kě)電離(lí)脂質。脂質納米顆粒中使用的(de)可(kě)電離(lí)脂質的(de)一(yī)個關鍵特征是,通過TNS染料結合試驗測定,LNP中可(kě)電離(lí)脂質的(de)pKa應在6-7範圍內(nèi)。理(lǐ)論上計算的(de)大多數可(kě)電離(lí)基團的(de)pKa在8-9.5範圍內(nèi),如(rú)下所示在氮原子(zǐ)上,使用商(shāng)業軟件理(lǐ)論上估計水介質中的(de)這些值。pKa從理(lǐ)論值下降2-3個點至TNS值是由于脂相中質子(zǐ)的(de)溶劑化能量更高(gāo),導緻脂相中的(de)pH值比水相高(gāo)2-3個點,在TNS測定期間測量pH值[102]。
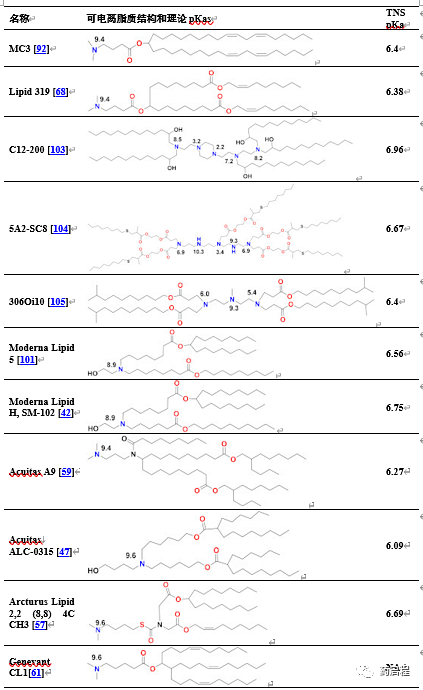
由于siRNA産品需要重複給藥治療慢性疾病,人們(men)擔心MC3中二亞油酸烷基尾的(de)緩慢降解會導緻重複給藥的(de)蓄積和(hé)潛在毒性。MC3的(de)生物可(kě)降解版本脂質319(表2)是通過用在體內(nèi)易于被酯酶降解的(de)伯酯取代每個烷基鏈中兩個雙鍵中的(de)一(yī)個而産生的(de)[68]。觀察到脂質319在肝髒中的(de)半衰期小于1小時,而其在肝髒中保持與MC3相似的(de)基因沉默效率。在體內(nèi)證實了降解産物,以及其分泌和(hé)脂質319的(de)無毒性質。在SARS-CoV-2的(de)臨床前和(hé)臨床研究中引用了脂質319的(de)研究,作為(wèi)BioNTech[49]和(hé)CureVac[53,69]産品中使用的(de)Acuitas LNP類别,盡管在倫敦帝國(guó)理(lǐ)工學(xué)院試驗[60]中Acuitas LNP遞送的(de)自(zì)擴增RNA被引用為(wèi)包含在最近的(de)專利申請中[59],這裏由Acuitas的(de)Lipid A9代表(表2)。最近,BioNTech批準的(de)BNT162b2中Acuitas可(kě)電離(lí)脂質的(de)同一(yī)性被披露為(wèi)ALC-0315[40](表2)。這些LNPs的(de)一(yī)個重要方面是,它們(men)是通過篩選IV給藥後肝髒中的(de)mRNA表達而開發的(de),可(kě)能還沒有(yǒu)完全優化用于基于mRNA的(de)疫苗的(de)肌內(nèi)給藥。
Moderna最近開發了一(yī)類新的(de)可(kě)電離(lí)脂質來替代MC3,主要是由于上述與MC3降解緩慢相關的(de)問題,但也努力通過實現比二亞油酸MC3烷基尾更大的(de)分支來提高(gāo)其效力[42,101]。這類新脂質具有(yǒu)乙醇胺可(kě)電離(lí)頭基,與含有(yǒu)一(yī)級降解酯(如(rú)Maier 2013)的(de)單個飽和(hé)尾連接,并與第二個飽和(hé)尾連接,後者使用降解性較低(dī)的(de)二級酯在7個碳原子(zǐ)後分支成兩個飽和(hé)C8尾,如(rú)脂質5[101](表2)。優化用于肝髒IV給藥,發現相似的(de)脂質H[42]或SM-102是疫苗肌內(nèi)(IM)給藥的(de)最佳選擇。分支增加是Acuitas追求的(de)共同特征,因為(wèi)Lipid A9共有(yǒu)5個分支鏈[59](表2),而Moderna LNPs有(yǒu)3個分支鏈。分支增加被認為(wèi)可(kě)産生具有(yǒu)更多錐形結構的(de)可(kě)電離(lí)脂質,因此,當與內(nèi)體中的(de)陰離(lí)子(zǐ)磷脂配對時,将發生更大的(de)膜破壞能力,遵循幾十年(nián)前概述的(de)分子(zǐ)形狀假設[12,91]。當IV給藥時,24h時在肝髒中檢測不到脂質5,而MC3以其初始劑量的(de)71%存在于肝髒中,驗證Lipid 5的(de)降解性。IV給藥後,Lipid 5在小鼠中熒光素酶表達的(de)效力是MC3的(de)3倍,在非人靈長(cháng)類動物中hEPO的(de)效力是MC3的(de)5倍。這些效力的(de)增加與胞內(nèi)體釋放增加一(yī)緻,可(kě)能是由胞內(nèi)體釋放增加引起的(de),對于Lipid 5,細胞中高(gāo)達15%的(de)mRNA從胞內(nèi)體釋放,而MC3為(wèi)2.5%,後者與之前使用siRNA測定的(de)MC3的(de)結果相似[106]。然而,在這些內(nèi)體釋放實驗中,MC3的(de)細胞攝取是Lipid 5的(de)4倍,因此這兩種LNPs在細胞質中釋放的(de)mRNA的(de)絕對量相似。在疫苗的(de)肌內(nèi)給藥中檢查了相同的(de)可(kě)電離(lí)脂質庫,同樣發現可(kě)降解,并且由于伯酯而迅速消除,并且對于流感核苷修飾的(de)mRNA%__,與MC3相比,在蛋白表達或免疫原性方面效價通常增加3-6倍。小鼠中%編碼的(de)免疫原,盡管非人靈長(cháng)類動物中的(de)免疫原性與5µg初免-加強免疫劑量下的(de)MC3相同[42]。脂質H或SM-102(表2)被确定為(wèi)最佳候選藥物,在結構上僅與通過伯酯的(de)二碳置換确定為(wèi)IV給藥最佳的(de)脂質5不同。脂質5 LNP的(de)pKa為(wèi)6.56,而脂質H LNP的(de)pKa為(wèi)6.68,表明IM與IV給藥相比,pKa略微增加可(kě)能有(yǒu)益,盡管該差異在試驗的(de)變異性範圍內(nèi)。大鼠肌肉注射部位的(de)組織學(xué)檢查表明,與MC3相比,Lipid HLNPs吸引的(de)中性粒細胞和(hé)巨噬細胞富集的(de)炎性浸潤較少,這可(kě)能會降低(dī)人體試驗中注射部位的(de)反應原性[42]。
目前SARS-CoV-2臨床試驗中的(de)mRNA脂質納米顆粒
5.1.BioNTech/Pfizer
Acuitas ALC-0315(表2)結合DSPC、膽固醇和(hé)PEG脂質是BioNTech SARS-COV-2試驗中的(de)遞送系統[40]。CureVac和(hé)倫敦帝國(guó)理(lǐ)工學(xué)院也可(kě)能使用ALC-0315,或可(kě)能使用A9(表2)。
BioNTech開始用4種mRNA編碼的(de)免疫原開發其SARS-CoV-2疫苗,其中2種是核苷修飾的(de),1種是未修飾的(de),1種是自(zì)我(wǒ)擴增的(de)。有(yǒu)兩種核苷修飾的(de)mRNA的(de)報道(dào):BNT162b1是編碼刺突蛋白受體結合域的(de)短(duǎn)的(de)~1kb序列,通過foldon三聚體結構域修飾,通過多價顯示增加免疫原性。較長(cháng)的(de)4.3kb BNT162b2編碼一(yī)個二脯氨酸穩定的(de)全長(cháng)膜結合刺突蛋白。BNT162b2最近獲得了歐盟和(hé)美國(guó)的(de)緊急批準。
在一(yī)項臨床前研究中,小鼠單次給予0.2、1和(hé)5µg BNT162b2後,可(kě)檢測到結合抗體和(hé)中和(hé)滴度。從最低(dī)劑量到最高(gāo)劑量增加一(yī)個數量級,在Th2細胞因子(zǐ)水平非常低(dī)的(de)CD4 + 和(hé)CD8 + 脾細胞中引起強烈的(de)抗原特異性Th1 IFNγ和(hé)IL-2應答[49]。引流淋巴結中還含有(yǒu)大量生發中心B細胞以及CD4 + 和(hé)CD8 + 濾泡輔助性T(Tfh)細胞計數升高(gāo),這些細胞先前被确定為(wèi)mRNA LNP疫苗中LNP單獨誘導的(de)一(yī)部分[33]。在非人靈長(cháng)類動物中,30µg或100µg的(de)初免-加強免疫劑量引起的(de)結合抗體和(hé)中和(hé)滴度是人恢複期試驗組的(de)10倍以上,并且産生強烈的(de)Th1偏倚T細胞應答,該應答被認為(wèi)對預防疫苗相關的(de)增強呼吸道(dào)疾病很重要[107]。在有(yǒu)限數量(6)的(de)攻毒恒河猴中,兩次100µg劑量在支氣管肺泡灌洗和(hé)鼻拭子(zǐ)中檢測不到病毒滴度。
較小mRNA編碼免疫原BNT162b1的(de)1期臨床試驗計劃在第1天和(hé)第21天給予10、30和(hé)100µg劑量。中等劑量30µg誘導的(de)抗體結合和(hé)中和(hé)滴度分别是人恢複期組的(de)30倍和(hé)3倍。由于首次給藥後存在重度注射部位疼痛,因此未給予100µg劑量進行(xíng)加強劑量。30µg加強劑量組100%的(de)受試者報告了注射部位疼痛,但嚴重程度為(wèi)輕度或中度。以30µg劑量第二次接種疫苗後,幾乎所有(yǒu)受試者均發生輕度或中度全身不良事件發熱、寒戰或疲乏。該試驗還證明了外周血單核細胞對Th1偏倚T細胞的(de)強烈應答[50]。
一(yī)項2期試驗在年(nián)輕(18-55歲)和(hé)年(nián)長(cháng)(65-85歲)受試者組中比較了BNT162b1和(hé)BNT162b2[51]。老年(nián)受試者的(de)結合和(hé)中和(hé)抗體滴度略低(dī),但仍超過恢複期組。與年(nián)輕受試者相比,老年(nián)受試者的(de)不良反應嚴重程度也降低(dī)。與BNT162b1相比,在BNT162b2中發現全身不良事件(發熱、寒戰、疲乏)的(de)頻率顯著降低(dī)約兩倍。正是BNT162b2耐受性的(de)增加推動了其選擇進入3期試驗,最近宣布了94%的(de)有(yǒu)效性,因為(wèi)在安慰劑組中發生了162例COVID-19病例,而在接受兩次30µg BNT162b2給藥的(de)疫苗接種組中僅發現了8例病例[3]
5.2. Moderna
在Moderna的(de)研究中,核苷修飾的(de)mRNA編碼免疫原是一(yī)種跨膜錨定的(de)二脯氨酸穩定的(de)融合前刺突,具有(yǒu)天然的(de)furin裂解位點,并在原型MC3 LNP基礎上的(de)LNP中遞送,隻是用Lipid H(SM-102)替代MC3[41,42]。該mRNA LNP(mRNA-1273)在第1天和(hé)第21天以1µg劑量注射時在幾種小鼠種屬中誘導中和(hé)抗體,但在0.1µg劑量時未誘導中和(hé)抗體[44]。T細胞應答似乎是平衡的(de)Th1/Th2應答,在小鼠适應的(de)病毒攻毒模型中,小鼠肺和(hé)鼻甲中的(de)病毒滴度在2次劑量1µg給藥後降低(dī)至基線,但在0.1µg給藥後未降低(dī)。在恒河猴中,2劑100µg劑量在外周血中産生高(gāo)結合和(hé)中和(hé)滴度以及Th1偏倚反應,也涉及強烈的(de)Tfh反應[45]。兩個10µg劑量組的(de)滴度和(hé)T細胞應答顯著降低(dī)。同樣,100µg劑量能夠将支氣管肺泡灌洗液和(hé)鼻拭子(zǐ)中的(de)病毒滴度降低(dī)至基線,而10µg僅在肺部降低(dī)。
在1期研究中,每組15例患者接受2劑25、100或250µg,間隔4周,結合和(hé)中和(hé)滴度比100µg劑量的(de)恢複期高(gāo)約10倍,約相當于25µg的(de)恢複期[46]。100µg和(hé)250µg劑量組所有(yǒu)受試者均報告征集性不良事件,250µg組14例受試者中的(de)3例報告重度不良事件并停藥。在随後的(de)老年(nián)患者(56-71歲和(hé)71歲以上)1期研究中,發現25µg和(hé)100µg劑量産生的(de)結合抗體滴度高(gāo)于恢複期血漿,而100µg劑量的(de)中和(hé)滴度相當,但低(dī)于25µg劑量的(de)恢複期[43]。大多數患者(約80%)在第二次接種疫苗後仍發生不良事件,即使是在老年(nián)組。外周血分析顯示CD4 T細胞應答存在Th1偏倚。與25µg劑量相比,100µg劑量的(de)中和(hé)滴度更高(gāo),因此選擇該劑量用于3期試驗,中期結果顯示90例COVID-19病例在安慰劑組與5例在疫苗接種組具有(yǒu)94.5%的(de)有(yǒu)效性[2]。一(yī)個獨立的(de)委員會對Moderna的(de)3期試驗進行(xíng)了中期分析,發現嚴重不良事件包括9.7%的(de)參與者出現疲勞,8.9%出現肌肉疼痛,5.2%出現關節痛,4.5%出現頭痛,而在輝瑞/BioNTech的(de)3期試驗中,頻率較低(dī)的(de)是疲勞為(wèi)3.8%,頭痛為(wèi)2%[108]。
5.3. CureVac
The CureVac mRNA LNP(CVnCoV)是一(yī)種非化學(xué)修飾的(de)序列工程mRNA,編碼在Acuitas LNP中遞送的(de)二脯氨酸穩定的(de)全長(cháng)S蛋白,可(kě)能使用可(kě)電離(lí)脂質ALC-0315。在小鼠中使用2µg劑量時,檢查了兩次給藥之間的(de)周數,範圍為(wèi)1-4周,發現Balb/c小鼠中較長(cháng)的(de)間隔産生了較高(gāo)的(de)滴度和(hé)T細胞應答以及平衡的(de)Th1/Th2應答[53]。需要第二次給藥以産生中和(hé)抗體,0.25µg的(de)兩次給藥不足以産生中和(hé)抗體。在叙利亞金黃地(dì)鼠中,兩次10µg劑量(而非2µg)能夠将肺(而非鼻甲)中的(de)病毒滴度降低(dī)至基線。
在檢查2-12µg劑量的(de)1期臨床試驗中,僅在最高(gāo)12µg劑量下發現達到恢複期血清水平的(de)中和(hé)滴度,導緻正在進行(xíng)的(de)2期試驗納入更高(gāo)劑量16和(hé)20µg[52]。接受12µg劑量的(de)所有(yǒu)患者在每次給藥後均發生全身不良事件,大多數為(wèi)中度和(hé)重度,而 > 80%的(de)患者在輕度和(hé)中度水平發生局部注射部位疼痛。
5.4. TranslateBio
Translate Bio使用非修飾的(de)mRNA編碼雙突變形式的(de)二脯氨酸穩定的(de)刺突蛋白,并通過被引用為(wèi)基于可(kě)電離(lí)脂質C12-200[109]的(de)LNP進行(xíng)遞送,其可(kě)能是最近從ICE-[110]或基于半胱氨酸的(de)[55]可(kě)電離(lí)脂質家族合成的(de)候選物。在Balb/c小鼠中,0.2–10µg範圍內(nèi)的(de)兩次給藥導緻結合和(hé)中和(hé)滴度遠高(gāo)于恢複期水平。在非人靈長(cháng)類動物中,15、45和(hé)135µg劑量産生的(de)滴度均超過人恢複期組[56]。免疫應答也存在Th1偏倚。
5.5. Arcturus
Arcturus使用自(zì)擴增、全長(cháng)、未修飾的(de)mRNA編碼融合前SARS-CoV-2全長(cháng)刺突蛋白,通過LNP進行(xíng)遞送,該LNP使用可(kě)電離(lí)脂質與硫酯,通過兩個額外的(de)酯基将含胺的(de)頭基與脂質尾部連接。該家族中兩種可(kě)能的(de)可(kě)電離(lí)脂質是脂質10a([111]的(de)表4)或脂質2,2(8,8)4 C CH3([57]的(de)第33頁)(表2)。後者有(yǒu)三個分支,類似于Moderna Lipid H,但有(yǒu)一(yī)個可(kě)降解的(de)硫酯與頭基連接。觀察到自(zì)身擴增mRNA的(de)特征,即IM給藥後1周以上,熒光素酶報告基因表達維持在相當恒定的(de)水平,而常規mRNA表達迅速下降[58]。
單獨接種疫苗在C57BL/6小鼠中産生了令人驚訝地(dì)體重減輕和(hé)臨床評分增加。小鼠中僅需要2µg或10µg(而非0.2µg)單次給藥,即可(kě)在Th1偏倚應答中達到高(gāo)于100的(de)中和(hé)滴度,并具有(yǒu)高(gāo)水平的(de)抗原特異性T細胞應答。在K18-hACE2緻死小鼠激發模型中,2µg或10µg單次給藥也具有(yǒu)100%保護作用,100%存活,無體重減輕,肺和(hé)腦病毒滴度降低(dī)至基線水平。Arcturus已經完成了1期臨床試驗,劑量為(wèi)1-10µg,并選擇7.5µg進行(xíng)3期試驗[112]。
5.6.帝國(guó)理(lǐ)工學(xué)院
倫敦帝國(guó)理(lǐ)工學(xué)院使用Acuitas LNP遞送的(de)自(zì)擴增mRNA編碼的(de)融合前穩定的(de)刺突蛋白,該LNP在Lipid A9[60]代表的(de)專利[59]中進行(xíng)了描述(表2)。在Balb/c小鼠兩次注射0.01µg至10µg劑量範圍後,獲得了較高(gāo)的(de)劑量依賴性抗體和(hé)中和(hé)滴度。該應答存在強烈的(de)Th1偏倚,與較低(dī)的(de)0.1和(hé)0.01µg劑量相比,10和(hé)1µg劑量産生的(de)抗原特異性脾細胞應答高(gāo)3倍。這種疫苗的(de)1期臨床試驗即将開始。
5.7.朱拉隆功大學(xué)、賓夕法尼亞大學(xué)
朱拉隆功大學(xué)與賓夕法尼亞大學(xué)合作,正在使用Genevant LNP(可(kě)能是CL1脂質)開發一(yī)種天然的(de)加标免疫原核苷修飾的(de)mRNA LNP[61]。他們(men)的(de)目标是在2021年(nián)第1季度開始1期臨床試驗,并在2021年(nián)第4季度開始将疫苗分發給泰國(guó)和(hé)7個周圍的(de)低(dī)至中等收入國(guó)家。
5.8. Providence Therapeutics
Providence Therapeutics被授予加拿大衛生部許可(kě)進行(xíng)PTX-COVID-19B mRNA LNP疫苗人體臨床試驗的(de)通知[113]。C57BL6小鼠按照初免-加強免疫方案接受20µg劑量給藥後,對編碼受體結合域(furin裂解位點有(yǒu)或無突變的(de)全長(cháng)加标物)的(de)三種mRNA候選物進行(xíng)臨床前研究[114]。來自(zì)Genevant未披露脂質的(de)臨床前數據結果(可(kě)能與表2中的(de)CL1相似)顯示出對于全長(cháng)和(hé)furin突變有(yǒu)效負載的(de)穩健中和(hé)滴度,與[115]中觀察到的(de)數據相似。1期臨床試驗計劃于2021年(nián)第一(yī)季度開始,疫苗的(de)生産和(hé)分銷——等待監管批準——在同年(nián)進行(xíng)。
5.9.儲存和(hé)分銷
大多數在實驗室中制造的(de)RNA LNPs在4 °C下可(kě)穩定數天,但随後表現出體積增大和(hé)生物活性逐漸喪失,如(rú)熒光素酶表達[116]。在之前的(de)siRNA LNP制劑中,通常觀察到LNP聚集的(de)大小随時間增加[117]。為(wèi)了穩定用于儲存和(hé)分銷的(de)mRNA LNP疫苗,迄今為(wèi)止需要冷凍形式。Moderna COVID-19疫苗需要在-25 ℃~-15 ℃保存,但在2 ℃~8 ℃之間也可(kě)穩定長(cháng)達30天,在8 ℃~25 ℃之間可(kě)穩定長(cháng)達12 h[118]。輝瑞/BioNTech COVID-19疫苗需要在-80 ℃至-60 ℃下儲存,然後解凍并在2 ℃至8 ℃下儲存長(cháng)達5天,然後在注射前用生理(lǐ)鹽水稀釋[119]。
與Moderna疫苗所需的(de)常規冷凍溫度相比,輝瑞疫苗在分銷和(hé)儲存期間所需的(de)幹冰溫度更難達到。這些溫差背後的(de)原因并不明顯,因為(wèi)兩種疫苗均含有(yǒu)相似的(de)高(gāo)濃度蔗糖作為(wèi)冷凍保護劑。Moderna mRNA LNPs在Tris和(hé)醋酸鹽兩種緩沖液中冷凍[41],而Pfizer/BioNTech疫苗僅使用磷酸鹽緩沖液[40]。已知磷酸鹽緩沖液對冷凍不理(lǐ)想,因為(wèi)其易于沉澱,并在冰結晶開始時引起pH值突然變化[120,121]。凍幹對于mRNA LNPs一(yī)直具有(yǒu)挑戰性[116]。然而,Arcturus表示,他們(men)的(de)COVID-19 mRNA疫苗在凍幹形式下是穩定的(de),這大概會大大簡化分布,盡管這種凍幹制劑的(de)溫度穩定性尚未披露[122]。
原文來源:Automated Manufacture of Autologous CD19 CAR-T Cells for Treatment of Non-hodgkin Lymphoma.Front.Immunol.11:1941. DOI:10.3389/fimmu.2020.01941