您當前的(de)位置: 首頁 - 新聞資訊 - 詳細內(nèi)容
Life Med|脂質納米顆粒靶向遞送mRNA研發策略
湃客:Life Medicine 2022-06-28 07:06
針對近幾年(nián)席卷全球的(de)新型冠狀病毒(COVID-19),疫苗研發一(yī)直是布局重點和(hé)焦點,被寄予厚望。其中,BNT162b(商(shāng)品名Comirnaty)和(hé)mRNA-1273(商(shāng)品名Spikevax)兩款mRNA納米疫苗以其極高(gāo)的(de)保護效率和(hé)研發速度聞名于世,并迅速引發國(guó)內(nèi)外廣泛關注。目前,以mRNA疫苗為(wèi)研究熱點的(de)核酸疫苗被視(shì)為(wèi)是繼(減毒)滅活疫苗、亞單位疫苗之後的(de)第三代新型疫苗,正在引領疫苗研發的(de)潮流,相關産業也正如(rú)火如(rú)荼的(de)進行(xíng)中。“新冠”mRNA疫苗的(de)成功同時推動了全球範圍內(nèi)mRNA的(de)産業化進程。 這些事件的(de)背後實際上是mRNA分子(zǐ)優化、體內(nèi)遞送等底層相關技術取得的(de)長(cháng)足進展,特别是在脂質納米顆粒(LNPs)遞送平台的(de)突破。一(yī)般認為(wèi),LNPs是遞送mRNA最好的(de)選擇之一(yī),若要擴寬mRNA的(de)應用場景,研發靶向遞送LNPs技術至關重要。

底層技術的(de)發展加速mRNA應用
自(zì)20世紀60年(nián)代mRNA被發現以來,有(yǒu)關mRNA的(de)應用探索就一(yī)刻也不曾停止。mRNA分子(zǐ)具有(yǒu)不穩定性、免疫原性、無法高(gāo)效進入細胞等特點,在實際應用中非常受限。随着mRNA分子(zǐ)優化技術、遞送技術平台的(de)不斷發展,這些缺點正在慢慢地(dì)被克服。
其一(yī),mRNA分子(zǐ)優化平台,包括有(yǒu):1)序列優化的(de)進展,如(rú)5,3端非翻譯區序列的(de)篩選、多聚腺嘌呤(poly A)尾巴的(de)長(cháng)度優化、開放閱讀框(ORF)密碼子(zǐ)的(de)優選等;2)核苷酸化學(xué)修飾的(de)引入,如(rú)5-甲基尿苷和(hé)N1-甲基假尿苷的(de)使用不僅能降低(dī)mRNA的(de)免疫原性,還能提高(gāo)其穩定性;3)制備工藝的(de)提升,如(rú)體外轉錄(IVT)放大工藝的(de)成熟、加帽工序的(de)簡化、純化和(hé)質檢方法的(de)穩定等。其二,遞送載體平台,尤其是LNPs遞送技術的(de)相對成熟。一(yī)般來講,LNPs由四種成分組成,每種成分都扮演着相對重要的(de)角色:可(kě)電離(lí)陽離(lí)子(zǐ)脂質被認為(wèi)是LNPs中最重要的(de)成分,它直接決定了mRNA的(de)包裹效率和(hé)遞送效率;中性輔助磷脂(如(rú)DSPC、DOPE)和(hé)膽固醇脂質有(yǒu)助于提升LNPs的(de)穩定性以及轉染效率;聚乙二醇脂(PEG-Lipid)在調節LNPs尺寸、穩定性、半衰期、遞送效率等方面的(de)作用也十分明顯。值得指出的(de)是,LNPs中單一(yī)成分并非獨自(zì)行(xíng)使功能,各組分之間的(de)配比在mRNA的(de)實際應用中非常重要。
通過多手段研發技術,目前LNPs-mRNA已被應用到多個領域,包括疫苗研發、針對多種重大疾病的(de)蛋白替代療法、基因編輯療法、細胞療法等方面。
LNPs靶向遞送策略擴寬mRNA應用場景
mRNA精準遞送是保證治療效果的(de)必要條件之一(yī)。針對體表的(de)組織器官(如(rú)肌肉、眼等)可(kě)通過局部給藥方式實現,而體內(nèi)更深層次器官的(de)遞送則選擇靜脈注射更為(wèi)合适。靜脈給藥後LNPs介導的(de)肝髒靶向較容易實現,如(rú)何實現肝外的(de)選擇性遞送則具有(yǒu)挑戰。針對此科(kē)學(xué)問題,研究人員嘗試了多種策略,取得了不錯進展。本亮(liàng)點文章(zhāng)重點總結了近期發表的(de)幾類mRNA靶向遞送策略。
(一(yī))靶向分子(zǐ)修飾
在LNPs表面進行(xíng)靶向分子(zǐ)修飾是實現細胞靶向遞送最直接的(de)方法。Jonathan A. Epstein教授團隊最近利用CD5抗體修飾包裹了CAR mRNA的(de)LNPs,可(kě)提高(gāo)其體內(nèi)靶向T淋巴細胞的(de)能力。将上述mRNA制劑靜脈注射到心衰小鼠模型後,可(kě)在體內(nèi)對T細胞進行(xíng)重編程,使其形成有(yǒu)功能的(de)CAR-T細胞,可(kě)以靶向過度活躍的(de)心髒成纖維細胞,有(yǒu)效降低(dī)了心髒纖維化,并幫助小鼠恢複了心髒功能。Dan Peer教授團隊通過重組融合蛋白(MadCAM-1-D1D2-Fc)修飾LNPs技術,将mRNA選擇性遞送到特定白細胞亞群,在結腸炎小鼠模型中展現出了潛在的(de)治療前景。不同于抗體修飾,Gabriel A. Kwong課題組最近開發了一(yī)種光控的(de)多肽配體置換平台,可(kě)快速變換修飾到LNPs表面的(de)靶向抗原多肽,在體內(nèi)實現對多種抗原特異性T細胞群的(de)靶向mRNA遞送。以上修飾技術可(kě)顯著增強對特定細胞類型的(de)靶向遞送能力,但在特異性方面略顯不足。
(二)高(gāo)通量篩選
上文提到,可(kě)離(lí)子(zǐ)化陽離(lí)子(zǐ)脂質是LNPs中最重要的(de)成分。通過結構各異的(de)化學(xué)結構庫進行(xíng)高(gāo)通量篩選早已被證實是研發靶向LNPs最為(wèi)有(yǒu)效的(de)方法之一(yī),目前大多數LNPs是由此技術研發産生的(de),可(kě)實現肝、肺、脾、腦等器官的(de)mRNA遞送,但此方法相對盲目、工作量大。James Dahlman課題組結合“DNA條形碼”和(hé)深度測序技術,開發了一(yī)種新型的(de)高(gāo)通量篩選技術,簡稱為(wèi)FIND,可(kě)顯著提升LNPs的(de)篩選效率。他們(men)将Cre mRNA和(hé)特定序列的(de)DNA條形碼包裹到同一(yī)個LNPs中,隻需設計不同的(de)DNA條形碼就可(kě)制備出帶有(yǒu)特定“标簽”的(de)一(yī)系列LNPs-mRNA藥物。将這些“标簽”各異的(de)LNPs通過靜脈一(yī)起注射到Cre誘導表達tdTom的(de)轉基因小鼠中,利用流式細胞儀檢測tdTom陽性細胞,并結合DNA深度測序的(de)方法可(kě)鑒别出特定細胞靶向的(de)LNPs載體。通過該體系,他們(men)可(kě)同步篩選超200種LNPs,顯著提高(gāo)了LNPs的(de)篩選效率。
(三)可(kě)預測性LNPs優化
區别于高(gāo)通量篩選,如(rú)果給出明确的(de)LNPs設計原則,則會大大縮短(duǎn)研發周期,提高(gāo)研發效率。Daniel Siegwart課題組2020年(nián)在Nature Nanotechnology上報道(dào)了一(yī)種可(kě)預測性設計的(de)LNPs研發技術,命名為(wèi)SORT。在原有(yǒu)4組分LNPs基礎上,僅添加一(yī)種帶有(yǒu)不同電荷的(de)新脂質分子(zǐ)(SORT分子(zǐ)),則可(kě)實現mRNA在小鼠的(de)肝髒、脾髒、肺部的(de)靶向遞送和(hé)基因編輯。通過增加陽離(lí)子(zǐ)脂質能夠使mRNA特異遞送進入肺部;陰離(lí)子(zǐ)脂質能夠使mRNA特異進入脾髒;而可(kě)離(lí)子(zǐ)化陽離(lí)子(zǐ)脂質則會增強肝髒的(de)靶向遞送。重要的(de)是,SORT技術具有(yǒu)普适性,可(kě)在多種類型的(de)LNPs基礎上快速研發出肝外器官靶向LNPs。進一(yī)步機(jī)制探究發現,SORT分子(zǐ)可(kě)調控SORT-LNPs在器官水平的(de)生物分布、LNPs自(zì)身pka、及表面血清蛋白冠等,這些因素最終決定了LNPs在體內(nèi)的(de)靶向遞送能力。文中指出,在器官靶向遞送方面,LNPs表面的(de)血清蛋白冠起到最關鍵作用,識别這些獨特的(de)蛋白質可(kě)能會在未來研發靶向其他器官的(de)LNPs方面有(yǒu)所幫助。
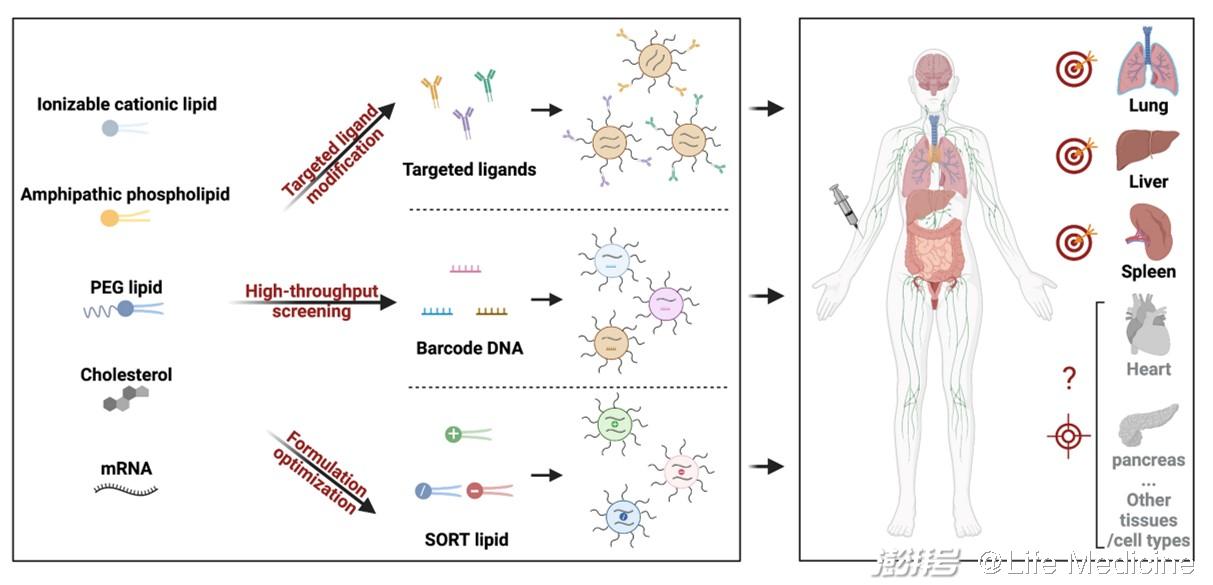
圖1. 體內(nèi)靶向遞送mRNA-LNPs的(de)研發策略。
總結與展望
器官選擇性遞送對于拓寬mRNA臨床應用至關重要。本文提到的(de)幾種代表性策略在一(yī)定程度上提出了解決方案,但各有(yǒu)不足之處。如(rú)何開發出靶向其他重要器官(如(rú)心髒、胰腺、腎髒)的(de)LNPs、如(rú)何實現對特定髒器中特定細胞類型的(de)靶向遞送都是未來需要解決的(de)重要問題。随着研究人員對mRNA靶向遞送技術的(de)深入研究,相信未來會有(yǒu)更多的(de)靶向遞送策略研發出來用于精準醫療研究。
參考文獻:
Cheng, Q., et al. (2020). Selective organ targeting (SORT) nanoparticles for tissue-specific mRNA delivery and CRISPR-Cas gene editing. Nat Nanotechnol 15, 313-320.
Dammes, N., et al. (2021). Conformation-sensitive targeting of lipid nanoparticles for RNA therapeutics. Nat Nanotechnol 16, 1030-1038.
Dilliard, S.A., et al. (2021). On the mechanism of tissue-specific mRNA delivery by selective organ targeting nanoparticles. Proc Natl Acad Sci USA 118, e2109256118.
Han, X., et al. (2021). An ionizable lipid toolbox for RNA delivery. Nat Commun 12, 7233.
Kong, N., et al. (2022). Intravesical delivery of KDM6A-mRNA via mucoadhesive nanoparticles inhibits the metastasis of bladder cancer. Proc Natl Acad Sci U S A 119, e2112696119.
Liu, S., et al. (2021). Membrane-destabilizing ionizable phospholipids for organ-selective mRNA delivery and CRISPR-Cas gene editing. Nat Mater 20, 701-710.
Rurik, J.G., et al. (2022). CAR T cells produced in vivo to treat cardiac injury. Science 375, 91-96.
Sago, C.D., et al. (2018). High-throughput in vivo screen of functional mRNA delivery identifies nanoparticles for endothelial cell gene editing. Proc Natl Acad Sci U S A 115, e9944-e9952.
Su, F.Y., et al. (2022). In vivo mRNA delivery to virus-specific T cells by light-induced ligand exchange of MHC class I antigen-presenting nanoparticles. Sci Adv 8, eabm7950.
Xiao, Y., et al. (2022). Emerging mRNA technologies: Delivery strategies and biomedical applications. Chem Soc Rev, DOI: 10.1039/d1cs00617g.
原文鏈接:https://doi.org/10.1093/lifemedi/lnac004
